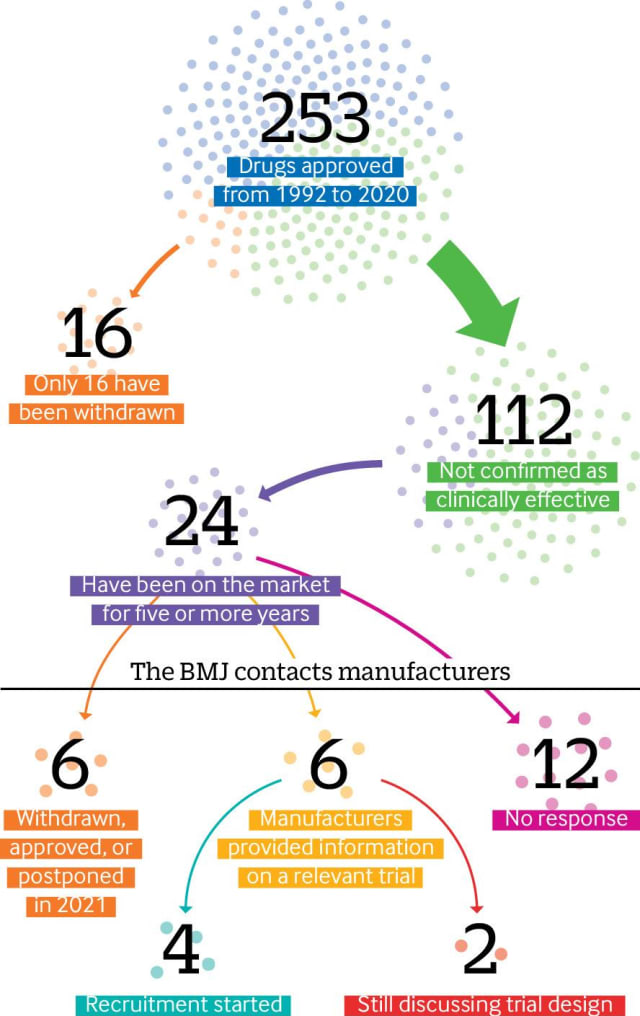
1992 führte die US-amerikanische Food and Drug Administration ihren beschleunigten Zulassungsweg für Medikamente ein. In den 29 Jahren wurden 253 Medikamente auf diese Weise zugelassenen. Dabei wurde knapp die Hälfte (112) nicht als klinisch wirksam bestätigt. Das ergaben Recherchen des online Nachrichtenportals
BMJ Medicine. Der Grund, weshalb die Kritik an der «FDA» und deren beschleunigten Zulassungsverfahren erneut aufgeflammt ist, ist deren jüngste Zulassung des kontrovers diskutierten Demenz-Mittels Aducanumab (Aduhelm). Medinside berichtete
hier darüber.
Von diesen 112 Medikamenten sind ein Fünftel (24) seit mehr als fünf Jahren auf dem Markt und einige seit mehr als zwei Jahrzehnten – oft mit einem hohen Preisschild. Eine weitere Analyse der FDA-Daten durch «BMJ» zeigt, dass nur 16 Medikamente, die im beschleunigten Verfahren zugelassen wurden, jemals zurückgezogen wurden (siehe Illustration unten).
Die meisten von ihnen zeigten sich als unwirksam; in einigen Fällen wurden die Bestätigungsstudien nie durchgeführt. Celecoxib (Celebrex), das 1999 eine beschleunigte Zulassung zur Behandlung der familiären adenomatösen Polyposis erhielt, war 12 Jahre lang auf dem Markt, bevor die FDA Pfizer schliesslich aufforderte, es freiwillig für diese Indikation zurückzuziehen, da die Wirksamkeitsstudien nie durchgeführt wurden.
Wirksamkeitsstudien sind Pflicht
Im Rahmen der beschleunigten Zulassung muss der Hersteller Studien nach der Zulassung durchführen – sogenannte Phase-IV-Bestätigungsstudien -, um «den erwarteten klinischen Nutzen zu überprüfen». Wenn diese Studien keinen Nutzen zeigen, kann die Zulassung des Medikaments storniert werden.
«BMJ» befragte die Hersteller von 24 Medikamenten, die seit mehr als fünf Jahren auf dem Markt sind, ob sie Phase-IV-Studien durchgeführt hätten oder nicht. Sechs Medikamente waren zurückgezogen, genehmigt oder verschoben worden. Von den verbleibenden 18 Medikamenten wurden nur für einen Drittel relevante Studieninformationen bereitgestellt; nur vier der Befragten hatten begonnen, Patienten zu rekrutieren, während zwei Unternehmen sagten, dass sie noch mit der FDA über das endgültige Studiendesign diskutierten.
Elf Unternehmen (die 12 Medikamente vertreten) reagierten nicht auf die Anfrage, darunter Sanofi Genzyme, das für Clofarabin (Clolar) verantwortlich ist, ein Medikament gegen pädiatrische rezidivierte oder refraktäre akute lymphatische Leukämie, das seit 17 Jahren ohne Bestätigungsstudie auf dem Markt ist.
Sorge wegen gesundheitlicher Schäden
Nun sind Experten darüber besorgt, dass die Medikamente zum Nachteil der Patienten sind, zu einem gesundheitlichen Schaden führen könnten und dass der Steuerzahler ausgenutzt wird.
«Diese Produkte haben regelmässig Nebenwirkungen bei Patienten. Wir machen uns Sorgen, dass wir Medikamente auf dem Markt haben, die keine Wirksamkeit haben, aber sicherlich vorhersehbare Schäden anrichten», wird Huseyin Naci, Professor für Gesundheitspolitik an der London School of Economics in Grossbritannien, zitiert.
Daten unvollständig und veraltet
Es geht noch weiter: 2015 ergab eine Überprüfung der beschleunigten Wege der FDA durch das US Government Accountability Office, dass die «Daten zu Post-Market-Sicherheitsfragen und Studien als unvollständig, veraltet sowie als ungenau befunden wurden.» Zudem wurden die «inkonsistenten Entscheidungen der FDA nach negativen oder mehrdeutigen Bestätigungsdaten» hervorgehoben.
Im Whitepaper der Überprüfung heisst es: «Abgesehen von Sicherheitsbedenken hat es die Agentur vorgezogen, die Zulassung nicht zu entziehen, selbst wenn Post-Marketing-Studien keinen Behandlungseffekt auf den primären klinischen Endpunkt zeigten. Angesichts solcher Vorfälle haben einige Gesundheitsvorsitzende argumentiert, dass die Standards der FDA für Beweise zu niedrig sind.
«BMJ» erklärt: Sobald die Wirksamkeit nicht klar sei, verwende die FDA sogenannte Surrogatendpunkte als Ersatz für ein direktes Mass dafür, wie sich ein Patient fühlt, funktioniert oder überlebt. Steven Pearson, Dozent an der Harvard Medical School in Massachusetts, sagt dazu, dass es sehr wenig Transparenz darüber gebe, wie die die FDA ihre Entscheidungen treffe. Es fühle sich etwas ad hoc an.
Ein weiteres Problem laut «BMJ» ist, dass selbst nach Bestätigungsstudien, viele Hersteller die gleichen «Surrogatendpunkte» verwenden, die in den Vorabgenehmigungsstudien verwendet wurden, anstelle von klinischen Ergebnissen. Dies bedeute, dass kein wirkliches Verständnis der Wirksamkeit gewonnen worden sei. Naci geht noch weiter und sagt, dass der aktuelle FDA-Prozess den Pharmaunternehmen falsche Signale sende und ihnen ermögliche, Medikamente mit niedriger Evidenzbasis auf dem Markt zu bringen.
Beschleunigter Weg nützlich, aber ...
Trotz aller Bedenken waren sich alle Experten, die mit «BMJ» sprachen, darüber einig, dass der beschleunigte Weg trotzdem nützlich sei und für die Patienten vorteilhaft. Die FDA müsse allerdings bei der Durchsetzung ihrer eigenen Regeln strenger sein, härter gegen die Unternehmen vorgehen und entsprechende Massnahmen ergreifen.
Weitere Vorschläge, die im IceR-Whitepaper dargelegt werden, umfassen die Stärkung der Auswahl von «Surrogatendpunkten», die Regulierung des Preises beschleunigter Medikamente sowie die regelmässige Überprüfung und Erneuerung der Zulassung, um sicherzustellen, dass sie weiterhin den Risiko-Nutzen-Kompromiss rechtfertigt.
Ein FDA-Sprecher erklärt, dass die Agentur «verpflichtet ist, mit Sponsoren zusammenzuarbeiten, um sicherzustellen, dass Bestätigungsstudien rechtzeitig abgeschlossen werden. Wir erwarten von den Sponsoren, dass sie alle erforderlichen Ressourcen einsetzen, um die Studien so effektiv wie möglich voranzutreiben, mit dem Ziel, die Studien so schnell wie möglich abzuschliessen und gleichzeitig die Qualität der Daten und die Robustheit der Ergebnisse zu gewährleisten.»