Konkret ging es darum, dem interessierten Teilnehmerkreis die aktuell evidenzbasierten Möglichkeiten und daraus resultierenden Optimierungspotenziale der Pharmakogenetik in der Klinik darzustellen. Immerhin wurden schon etliche wichtige Daten vor 10 Jahren publiziert. Dies im Kontext der Medikamentensicherheit, Wirksamkeitsoptimierung wie auch Nebenwirkungs-/Komplikationsvermeidung sowie Kosteneffizienz. Insgesamt wurde die Rolle der Pharmakogenetik in der modernen personalisierten Medizin erörtert.
So fanden sich am 14. Januar beim Lake Side im Zürcher Seefeld wie auch am 13. Februar in den Räumlichkeiten der Klingenden Sammlung in Bern interessierte Teilnehmer zusammen.
Dabei referierten folgende Experten über ihre Praxiserfahrungen, welche einen Einblick gaben, was bereits heute mit diesem Mosaik der personalisierten Medizin möglich ist zu Gunsten der Patienten, Behandler und schlussendlich auch Kostenträger.
Prof. Dr. phil. nat. Carlo Largiadèr
Inselspital BernProf. Dr. med. Markus Béchir
Hirslanden AarauProf. Dr. med. Stefan Russmann
Drugsafety.chDr. med. Dorothée Rhein Straub
Luzerner Kantonsspital SurseeDr. phil. nat. Katja Ludin
Labor RISCHMichael Perny, PhD
Labor RISCH
Prof. Dr. phil. nat. Carlo Largiadèr, Leiter der Abteilung Pharmakogenetik am Zentrum für Labormedizin des Inselspitals Bern und Vizedirektor am Universitätsinstitut für Klinische Chemie der Universität Bern, leitete die Praxisvorträge ein. Als Leiter eines unabhängigen Diagnostiklabors mit eigenem Pharmakogenetikangebot und einer universitären Forschungsgruppe mit Schwerpunkt Pharmakogenetik bot er eine Perspektive ohne Interessenskonflikte zu den Fortbildungsorganisatoren.
Er begann mit einer Einführung in die Grundlagen der Pharmakogenetik um dann einen umfassenden Überblick des aktuellen Stands sowie der Möglichkeiten und noch vorhandenen Restriktionen der Pharmakogenetik zu geben.
Prof. Dr. phil. nat. Carlo Largiadèr wies auf das grosse Potential der Pharmakogenetik für die Vermeidung unerwünschter Medikamentennebenwirkungen hin. Mehrere Studien belegen die Relevanz von Nebenwirkungen und ca. 5% der akutstationären Hospitalisierungen gehen auf ebendiese zurück. Somit zweifelsohne ein Bereich, dem es sich zu widmen lohnt.
Das zweite relevante Praxispotential liegt in der Wahl des richtigen Medikaments, da im Durchschnitt nur bei 50% der verabreichten Medikamente auch eine Wirkung festgestellt werden kann. Demgemäss liegt auch hier ein wichtiges Potential durch genetische Marker die Effizienz der Medikamententherapie zu erhöhen.
Genetische Varianten können im gesamten Mechanismus des Medikamentenstoffwechsels und der Medikamentenwirkung eine Rolle spielen. Konkret beinhaltet dies sowohl die Aufnahme, Verteilung, Verstoffwechselung und Ausscheidung eines Medikamentes, als auch dessen Wirkung am Zielort.
Beim Gen CYP2D6 gibt es beispielsweise das Auftreten von Gendeletionen, d.h. dieses Gen ist bei bestimmten Patienten gar nicht vorhanden. Der daraus resultierende Phänotyp ist ein sogenannter «Poor Metabolizer» mit fehlender Enzymaktivität des Cytochroms 2D6. Medikamente, die über dieses Enzym aktiviert werden, wie dies beim Schmerzmittel Tramadol der Fall ist, entwickeln somit keine schmerzlindernde Wirkung und es muss auf ein anderes Medikament gewechselt werden. In der Schweiz sind immerhin etwa 8% der Patienten CYP2D6 «Poor Metabolizer».
Eine anderer Phänotyp ist der «Ultra Rapid Metabolizer», mit einer stark erhöhten Enzymaktivität. Dieser kommt durch eine Genduplikation zustande, d.h. es gibt im Genom dieser Patienten mehr als die zwei üblicherweise vorhandenen Kopien des Gens.
In beiden Fällen kann es somit je nach Medikament entweder zu einem zu hohen Wirkspiegel mit einem erhöhten Risiko für das Auftreten von Nebenwirkungen kommen, oder zu einem erniedrigten Wirkspielgel und ausbleibender Medikamentenwirkung.
Unabhängig von der genetischen Disposition spielen zusätzlich auch andere Faktoren, wie z.B. Medikamenteninteraktion eine wichtige Rolle beim Auftreten von Nebenwirkungen. Demnach ist deren parallele Prüfung nicht nur eine Option, sondern ein Muss.
In der Schweiz darf bei der Verschreibung bestimmter Medikamente (z.B. 5-Fluoruracil, Capecitabin, 6-Mercaptopurin, Azathioprin, Irinotecan, Abacavir, Carbamazepin) von jedem Arzt ein pharmakogenetischer Test zu Lasten der Kostenträger verschrieben werden. Alle anderen pharmakogenetischen Tests müssen nach Indikation von einem Facharzt für Klinische Pharmakologie verschrieben werden, damit eine Kostenübernahme erfolgt. Ansonsten finanzieren sich diese Tests in Form der Selbstzahlerleistung.
Prof. Dr. phil. nat. Carlo Largiadèr wies explizit darauf hin, dass die Evidenz in Pharmakogenetik bereits seit über einem Jahrzehnt existiert und stetig zunimmt, was deren klinische Anwendung zunehmend bevorteilt und inzwischen eine feste Berechtigung bei gewissen Indikationen und Wirkstoffgruppen aufweist. Dies skizzierte er konkret am Beispiel des Enzyms Dipyrimidindehydrogenase (DPD), kodiert durch das Gen DPYD, dessen hohe Relevanz für das Risiko schwerwiegender Nebenwirkungen bei der Verabreichung von 5-Fluoruracil seit mehr als 20 Jahren bekannt ist. DPD ist das Schlüsselenzym im Abbau von Fluoroprymidinen. Patienten mit DPYD-Genvarianten, die eine verminderte Enzymaktivität aufweisen, erfahren dadurch ein stark erhöhtes Risiko für das Auftreten einer schweren oder sogar lebensbedrohlichen Toxizität im Rahmen einer auf Fluoroprymidinen basierenden Chemotherapie.
In den letzten Jahren hat sich das Verständnis dieses Sachverhalts sowie entsprechender Adaptionen in der Behandlung dieser Patienten deutlich verbessert. An diesem Beispiel zeigt sich exemplarisch die berechtigte Durchsetzung relevanter Meilensteine für die klinische Implementierung pharmakogenetischer Gentypisierungen.
So hat eine prospektive holländische Studie für eine DPYD Risikomutation gezeigt, dass eine pharmakogenetisch basierte Dosisanpassung insgesamt nicht nur zu einer Reduktion der Nebenwirkungsrisikos in Mutationsträgern, sondern auch zu einer Reduktion der Gesamtkosten bei der Behandlung mit Fluoropyrimidinen führt.
Im Jahr 2018 hatte Frau PD Dr. phil. nat. Ursula Amstutz, ebenfalls am Zentrum für Labormedizin des Inselspitals Bern tätig, die Leitung bei der Aktualisierung der internationalen CPIC (Clinical Pharmacogenetic Implementation Consortium) Leitlinie für DPYD und 5-Fluoruracil oder Capecitabine basierte Chemotherapien. Diese empfiehlt für Patienten, welche Träger einer der vier Risikomutationen sind, eine Dosisreduktion um 50% als Startdosierung mit anschliessender Überprüfung des Medikamentenspiegels.
Prof. Dr. med. Markus Béchir, Leiter des Zentrums Innere Medizin der Hirslanden Klinik Aarau, berichtete im Wesentlichen anhand anonymisierter Patientenfälle über die konkreten Outcomemehrwerte durch den Einsatz von Pharmakogenetik in der klinischen Anwendung.
Dies u.a. am konkreten Beispiel der Verschreibung von Clopidogrel bei Patienten mit Status nach Herzinfarkt, von welchen die Hirslanden Klinik Aarau ca. 300 pro Jahr behandelt. Studienbasiert sowie in der Praxis kann dementsprechend nachgewiesen werden, dass die Komplikationsrate (MACCE = major adverse cardiovascular/cerebrovascular event) bei genprofiladaptierter Diagnostik und Behandlung bis um das Fünffache abnehmen kann.
So auch exemplarisch dargestellt bei einem seiner Patienten im Status nach Herzinfarkt sowie weiteren relevanten Komorbiditäten. Nach jahrelanger Antikoagulation und dem so dann pharmakogenetik-profilbedingten Assessment wurde gemeinsam festgestellt, dass die Blutverdünnung in den Vorjahren deutlich reduziert und hochwahrscheinlich insuffizient erfolgt ist mitsamt den resultierenden Risiken für den Patient. Auf diesem Weg konnten diese überwunden werden und dem Patient deutlich mehr Schutz geboten werden. Und dies wie zuvor beschrieben, in relevantem statistischen Ausmass, so dass dies keine Einzelfalldarstellung darstellt.
Zudem konstatierte Prof. Dr. med. Béchir, dass bei 50% seiner Schmerzpatienten die pharmakogenetische Analyse einen relevanten Hinweis darauf gibt, dass die bisherige Medikamentenverschreibung nicht profilgerecht optimal und damit wirkungsreduziert ausgestaltet war. Dies wurde erst erkennbar nach dem Pharmakogenetik-Test und entsprechender Therapieanpassung auf dessen Basis.
Ergänzend konstatierte er im Rahmen seines Resümees u.a. Folgendes:
- Pharmakogenetik relativiert teilweise die bestehende Datenlage aufgrund neuer Evidenz und damit zu überwindender tradierter medikamentöser Therapieformen
- Bisher als Therapiegrundlage verwendete Studienergebnisse müssen hinterfragt und ggf. verworfen werden zu Gunsten neuer Studiendesigns, Erkenntnisse und Guidelines
- Transformation der klassischen Evidence Based Medicine hin zu Evidence Based (Pharmaco)Genetics
- Die personalisierte Medizin findet Eingang in die klinische Routine
- Die ärztliche Tätigkeit wird durch Pharmakogenetik deutlich aufgewertet
- Fazit: Qualitätssteigerung der Medizin, Reduktion von Nebenwirkungen und Komplikationen und hohes gesundheitsökonomisches Effizienzpotenzial
Prof. Dr. med. Stefan Russmann, Inhaber
drugsafety.ch und in der Lehre tätig an den Universitäten Zürich und Boston sowie der ETH Zürich wie auch klinisch an den Hirslanden Kliniken Zürich, Aarau und Luzern, sprach u.a. über die konkrete Praxis der Pharmakogenetik.
So werden im Rahmen des in der Schweiz verfügbaren Partnerangebotes RISCH/SONOGEN auf Basis eines 16 Gene umfassenden und speziell auf die Pharmakogenetik ausgerichteten Panels die klinisch relevanten Profilvarianten eines jeden Patienten untersucht und erarbeitet.
Prof. Dr. med. Russmann zeigte am Beispiel des Wirkstoffs Tamoxifen zur Behandlung von Brustkrebserkrankungen auf, dass bereits schon dessen beiliegende Fachinformationen (Beipackzettel) die genprofiladaptierten Hinweise erhält, so dass auf Basis des zuvor erwähnten Profils eine profunde Therapieentscheidung getroffen werden kann. Dies einerseits zur Gabe von Tamoxifen an sich wie auch in Interaktion mit weiteren Wirkstoffen, so dass bspw. die gleichzeitige Anwendung von CYP2D6-Inhibitoren parallel zu Tamoxifen grundsätzlich vermieden werden soll.
Neben diesen profilbildenden Informationen enthält der Abschlussbericht im Anschluss an die pharmakogenetische Interpretation durch SONOGEN kodierte Ergebniscluster, welche den behandelnden Ärzten klar verständlich aufzeigen, bei welchen Wirkstoffen keinerlei Handlungsbedarf besteht sowie bei welchen derer Vorsicht geboten bzw. ein relevantes Risiko vorliegt. Diese übersichtgebenden Grundlageninformationen werden ergänzt um jeglich aktuell verfügbaren wie notwendigen Detailinformationen in stets umfassender Referenz auf dessen Quellen bzw. deren Verbindungen.
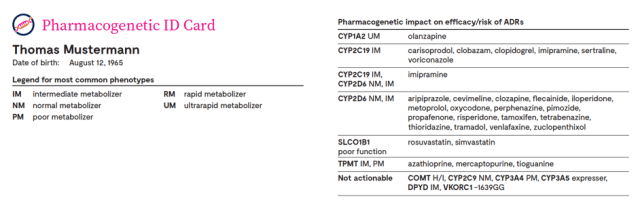
Patientenseits wird im Rahmen der Ergebnisübermittlung an den behandelnden Arzt zudem ein «pharmakogenetischer Pass» übergeben, so dass der Patient sein persönliches Profil sowie die auf seinen Varianten entsprechenden anders als erwartet verstoffwechselten Wirkstoffe immer im Kreditkartenformat bei sich tragen kann. Dies für mehrerlei Einsatzzwecke, wie bspw. beim Arztbesuch, dem Notfall beim Einsatz des Rettungsdienstes oder auf der Notfallstation wie auch bei Apothekenbesuchen oder sonstigem Bedarf des Verständnisses der individuellen Medikamentenverträglichkeit bzw. -verstoffwechslung.
Anhand mehrerer Praxisbeispiele zeigte Prof. Dr. med. Russmann zudem auf, dass die abschliessende Beurteilung des klinischen Pharmakologen den zuweisenden Kollegen im Bedarfsfall konkrete Therapieempfehlungen gewährleistet und in Form eines umfassenden Berichts legitimiert. So wird durch diese fachärztliche Beratung jenen den Patient behandelnden Fallführern im gesamten Prozess jederzeit die maximal verfügbare Kompetenz gewährleistet, so dass diese zu Gunsten der Sicherheit und Wirksamkeitsoptimierung für die Patienten eingesetzt werden kann.
Aktuelle Studien beweisen demgemäss, dass bei mehr als 99% der Patienten die pharmakogenetische Analyse mindestens eine potenziell klinisch relevante Variante ausweist, welche die Wirkstoffwahl und Dosierung der Medikamente beeinflusst.
Dazu hat Prof. Dr. med. Russmann die letzten 50 mit dem o.g. Pharmakogenetikpanel untersuchten Patienten ausgewertet und stellt seinerseits eine 100%-Quote des zuvor Genannten bei diesen fest.
Resümierend konstatierte er, dass diese eindrücklichen Praxiserfahrungen im Verhältnis zum dreistelligen Gesamtpreis eine mehr als interessante Preis-Leistungs-Mehrwert-Relation aufweisen und sich diese zunehmend weiter entwickeln und beweisen wird, so dass die klinische Anwendung dieses neuen Bausteins der personalisierten Medizin laufend zunimmt.
Prof. Dr. med. Béchir wie auch Prof. Dr. med. Russmann berichteten dabei im Rahmen ihrer Zusammenarbeitsergebnisse von einer weiteren interessanten Erkenntnis: Vorteil des fokussiert erweiterten 16-Gen-Pharmakogenetik-Panels ist ebenso der „Beifang“ auch in jenen Bereichen, welche zum Analysezeitpunkt nicht therapierelevant sind, dies aber in Zukunft werden können. So erhält man fast zum gleichem Preis der Analyse eines oder weniger Gene mit dem o.g. Spezialpanel über die aktuell verfügbare vollumfängliche Information, welche auch in Zukunft jederzeit und ohne Zeitverlust und weitere Kosten im Bedarfsfall angewendet werden kann.
Dr. med. Dorothée Rhein Straub, Co-Chefärztin Innere Medizin und Leiterin Notfallstation am Luzerner Kantonsspital Sursee, berichtete über die Vorteile der Kenntnis von pharmakogenetischen Informationen im Rahmen der akuten Notfallbehandlung.
So wurde deutlich, dass im Vergleich ohne Kenntnis des pharmakogenetischen Profils der Patienten die reale Gefahr besteht, in Unkenntnis dessen, Medikamente und Dosierungen derer zu verordnen, welche bei dem Patient entweder zu keinerlei Wirkung führen oder gar unerwünschte Nebenwirkungen und Komplikationen generieren. Gerade zur Vermeidung dessen kann die Verfügbarkeit der Informationen des von Prof. Russmann beschriebenen „Pharmakogenetik-Passes“ von entscheidender Bedeutung sein, ob ein Patient die richtige Behandlung erhält und vermeidbare Probleme ausgeschlossen werden können.
Aber nicht nur das. So skizzierte Frau Dr. med. Rhein Straub eindrücklich, dass beispielsweise im Kontext von Abhängigkeit sowie Überdosierungsphänomenen bei Opioiden das pharmakogenetische Profil eine einfache wie sehr wirksame Grundlage bildet, um die nicht selten schwerwiegenden bis tödlichen Folgen deutlich eindämmen zu können. Dies würde einen nicht unwesentlichen Beitrag leisten, welcher wie von Prof. Dr. med. Russmann dargestellt, preislich in Relation in keinerlei kritischem Verhältnis bewertet werden sollte – im Gegenteil.
Zudem kann diese Art der Profilbildung als Grundlage für den Arzt diesen wie auch die Patienten vor Fehlinterpretationen schützen. Denn auch Patienten die 100% compliant ihre Medikamente einnehmen, können aufgrund genetischer Varianten in den Laborwerten, bspw. dem Toxscreening, zu Unrecht bspw. positive Werte aufweisen, welche nicht der Realität entsprechen. Dann würde man dem Patienten ggf. zu Unrecht unterstellen, verbotene Substanzen wie z.B. Benzodiazepine zu sich genommen zu haben.
Dieser Schutz vor Fehlinterpretation stellt einen sehr relevanten Mehrwert dar, welche den zuvor von den Professoren Béchir und Russmann bereits dargestellten „Beifang“ ergänzt. Damit generiert die pharmakogenetische Testung des beschriebenen Panels einen Zusatznutzen, auf welchen Behandler wie Patienten bisher keinen Zugriff bzw. keine Kenntnis dessen Möglichkeit hatten.
Abschliessend referierten Frau Dr. phil. nat. Katja Ludin, Leiterin des humangenetischen Labors, sowie Michael Perny, PhD, Wissenschaftlicher Mitarbeiter Genetik/Andrologie, des Labor Risch darüber, wie das pharmakogenetische Panel sowie dessen Interpretation verordnet werden können und auch welche Technik dabei konkret im Labor eingesetzt wird. Dazu arbeiten alle Beteiligen wie initial bereits beschrieben mit der Firma Agena und deren Analysegeräte zusammen.
Bei dem gemeinsam zwischen RISCH und SONOGEN etablierten pharmakogenetischen Analyseangebot beträgt die Turnaroundtime von der Probeentnahme bis zur Berichtslegung in der Regel 10 Werktage.
Insgesamt fand an beiden Veranstaltungen ein vitaler und inspirierender Austausch statt bei inhaltlicher Einigkeit, dass die Sinnhaftigkeit der klinischen Anwendung von Pharmakogenetik im Rahmen der derzeit sinnvollen Einsatzgebiete derer keine „ob“- sondern eine „wie“-Frage ist.
Die Praxisreferate haben diesbezüglich aufgezeigt, dass die Anwendung in den evidenzbasierten Bereichen bereits realisiert, verfügbar und bewährt sind. Diese haben wie beschrieben den klinischen Alltag erreicht und werden auf Basis des studienbasierten Erkenntnisfortschrittes weitere Entwicklung und Verbreitung finden.
Dementsprechend überzeugt und motiviert konstatierten die Fortbildungsorganisatoren RISCH, SONOGEN und Agena sowie die referierenden klinischen Praxisanwender dass sich das Engagement der letzten Jahre methodisch bewährt und inhaltlich mit multifaktoriell nachweisbarem Praxisnutzen bewiesen hat.
Demnach werde nicht nur an diesem festgehalten, sondern dieses Thema weiterhin gemeinsam intensiv bearbeitet, um die zuvor dargestellten Mehrwerte allen relevanten Anspruchsgruppen niederschwellig zur Verfügung stellen zu können.
Dies stets im Sinne einer erhöhten Medikamentensicherheit, optimierten Wirkungsweise sowie reduzierten Eintrittswahrscheinlichkeiten von unerwünschten Nebenwirkungen bzw. kritischen Komplikationen. Und ergänzt um die daraus resultierenden positiven Nebeneffekte in Hinsicht auf Kosteneffizienz und Konformität betreffend Haftungs- und Regulatorienvorgaben.
Weitere Informationen zu den Referenten sowie deren klinischen Tätigkeiten finden Sie bei Interesse unter den folgenden Links:
Weitere Informationen zu ergänzenden Angeboten der Pharmakogenetik und Laboranalysen finden Sie bei Interesse unter den folgenden Links: