
Diese Folgen könnte der neue Alzheimer-Bluttest für die Branche haben
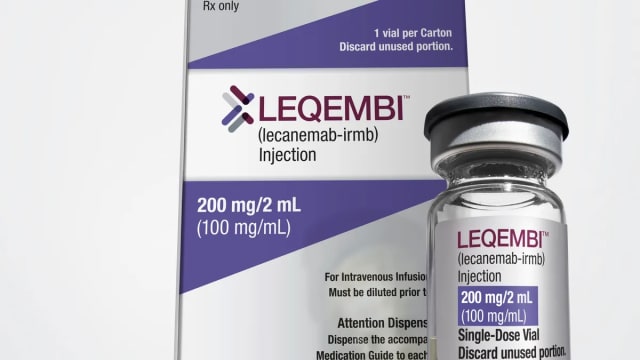
Bald kommt der neue Alzheimer-Bluttest in die Schweiz. Ärzte fragen sich, was er für Auswirkungen haben wird.
Loading

Bald kommt der neue Alzheimer-Bluttest in die Schweiz. Ärzte fragen sich, was er für Auswirkungen haben wird.

Die europäische Kommission hat Roche bereits die Zulassung für den neuen Bluttest zur Alzheimer-Diagnose erteilt.

Nahrungsergänzungsmittel füllen die Regale – in Apotheken, Supermärkten und Online-Shops. Aber viele Werbeversprechen sind unzulässig. Eine juristische Einordnung, wo die Grenzen verlaufen – und was bei der Vermarktung in der Schweiz zu beachten ist.

Die Volksinitiative zur medizinischen Versorgungssicherheit stösst in Bern auf Verständnis – aber nicht auf Zustimmung. Die Landesregierung präsentiert eine enger gefasste Alternative für mehr Arzneimittelsicherheit.

Über die Hälfte der neuen Medikamente bieten keinen echten Fortschritt. Und kaum je schaffen sie neue Lösungen für seltene Erkrankungen ohne Behandlungsmöglichkeiten.

Ambulanz- und Taxifahrer sterben seltener an Alzheimer als andere Berufsleute. Dies lässt ahnen, dass das richtige Training vorbeugend wirkt.

Der Geschäftsleiter der Regio-Spitex Limmattal wird der neue Chef der Spitex Zürich. Der bisherige CEO, Markus Reck, geht in Pension.

Ein Hirslanden-Belegarzt gab seine Login-Daten zu den Patientenakten weiter. Die Zugriffsrechte von Belegärzten seien aber kein grundsätzliches Problem, betont der Hirslanden-Sprecher.

Grosser Umbau in der Berner Lindenhofgruppe: Im Engeried gibt es künftig nur noch ambulante Radiologie und Arztpraxen. Der Rest wird an den Lindenhof und an den Sonnenhof verlegt.