Am Sonntags wurde es Gewissheit: Beim Phase-1-Test für ein neues Schmerzmittel in Frankreich verstarb eine Testperson. Fünf Männer sind immer noch hospitalisiert, auch sie trugen teils schwere neurologische Schäden davon.
Der Fall war am Freitag durch die französische Gesundheitsministerin Marisol Touraine öffentlich bekannt gegeben worden. Seither kamen mehr und mehr Details ans Licht.
Hier die wichtigsten Punkte:
1. Um welchen Wirkstoff geht es?
Der Versuch drehte sich um die Entwicklung eines neuen Schmerzmittels, und dabei um einen sogenannten FAAH Inhibitor. Das getestete Molekül hemmt also ein Enzym des körpereigenen Cannabinoid-Systems namens Fatty Acid Amide Hydrolase FAAH; dadurch soll das Schmerzempfinden gesenkt werden.
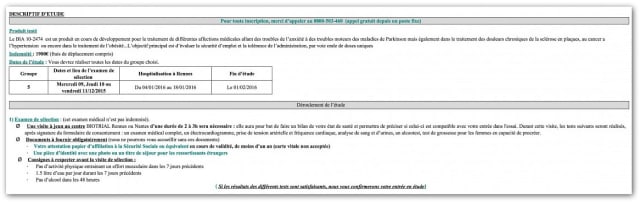
Der in Rennes getestete Stoff trug den Code BIA 10-2474. Wie das federführende Institut Biotrial den Probanden erklärte, sollte das neue Mittel am Ende für den Einsatz gegen diverse Erkrankungen überprüft werden, so gegen Angstzustände, gegen die motorischen Störungen bei Parkinson sowie gegen chronische Schmerzen bei multipler Sklerose oder Krebs.
2. Wie lief die Studie ab?
Der Test wurde vom Forschungs-Institut Biotrial in Rennes (Bretagne) durchgeführt, im Auftrag der
Pharma-Gesellschaft Bial, dem grössten Medikamenten-Hersteller von Portugal. Biotrial ist ein Auftrags-Forschungsunternehmen mit Niederlassungen in Rennes, Newark, Brüssel, London und Montreal.
Für diesen Test hatte es die Bewilligung der französischen Arzneimittelbehörde ANSM Ende Juni 2015 erhalten.
Der klinische Versuch mit BIA 10-2474 begann am 9. Juli 2015 in den Biotrial-Räumlichkeiten in Rennes. Zuvor war das Molekül an Tieren getestet worden, darunter Schimpansen. Bei den ersten Versuchen mit Menschen wurden 128 Versuchspersonen einbezogen; es waren sowohl Männer als auch Frauen im Alter von 18 bis 55 Jahren.
90 Personen erhielten BIA 10-2474 in unterschiedlichen Dosierungen und Frequenzen zur oralen Einnahme; 38 Probanden bekamen ein Placebo.
Diese Studienbeschreibung gab Biotrial den Versuchspersonen ab. Quelle: Breizh-Info.com
Die jetzt erkranken Personen bekamen ihr Mittel ab 7. Januar 2016. Sie gehörten zur Gruppe, welche die bislang höchsten Dosen erhielten (und diese Dosen auch in höheren Frequenzen als die Testpersonen davor). Drei Tage später, am 10. Januar, meldeten sich die ersten Probanden mit Symptomen. Am 11. Januar wurde der ganze Versuch abgebrochen.
Die Versuchspersonen erhielten 1'900 Euro Honorar.
3. Welche Symptome wurden festgestellt?
Als der erste Patient in die Universitätsklinik von Rennes eingeliefert wurde, vermuteten die Ärzte zuerst einen Schlaganfall. Es geht um neurologische Schädigungen von teils schwerem Ausmass.
Die MRI-Scans machten bei allen Betroffen nekrotische und hämorrhagische Schäden im Gehirn fest («lésions profondes dans le cerveau, de type nécrotique et hémorragique»).
Bei der Pressekonferenz des Universitätsspitals von Rennes sprach der behandelnde Neurologe, Gilles Edan, von «neurologischen Erscheinungsformen derselben Art, aber unterschiedlichem Schweregrad». Der Zustand aller Betroffenen – mit Ausnahme eines Patienten – habe sich in den ersten Tagen weiter verschlechtert.
4. Welcher Mechanismus verursachte die Schäden?
Dies ist – Stand Sonntagabend – noch unklar. Denkbar sei eine Toxizität im Molekül selber, welche auf der Ebene des zentralen Nervensystems wirksam wird, so Gilles Edan gegenüber den Medien. Möglich sei aber auch eine immunologische Reaktion.
5. Wieviele Betroffene gibt es?
Insgesamt erhielten 90 Versuchspersonen den Wirkstoff, bei sechs stellten sich schwere Nebenwirkungen ein, ein Mann starb. Die fünf anderen erkrankten Personen seien in einem stabilen Zustand, es müsse jedoch bei dreien befürchtet werden, dass sie bleibende Schäden davontragen. Betroffen sind allesamt männliche Probanden im Alter von 28 bis 49 Jahren.
6. Wie wird therapiert?
Hier liegt offenbar ein Problem. Weil das eingesetzte Molekül – und damit eben seine exakten Wirkungen – neu sind, können die Universitätsmediziner nicht auf eine Standardtherapie zurückgreifen. «Wir versuchen, die entzündliche Reaktion mit Kortikoiden unter Kontrolle zu halten», so der behandelnde Neurologe.
7. Gab es bereits zuvor ähnliche Probleme mit FAAH-Inhibitoren?
Nie in diesem Ausmass. Es wurden schon von anderen Pharmaunternehmen vergleichbare Versuche mit dieser Art von Schmerzmitteln durchgeführt, bislang ohne derart schwere Vorfälle. Pfizer hat derzeit einen
FAAH Inhibitor in Testphase 2.
8. Wie häufig sind solch schwere Probleme bei Phase-1-Versuchen?
Sie sind sehr selten. Im März 2006 gab es in London einen ähnlichen schwerwiegenden Fall. Damals war sechs gesunden Männern das neuartige Immuntherapeutikum
TGN1412 verabreicht worden. Nur Stunden später erlitten die Testpersonen multiple Organversagen. Hier waren aber keine Todesopfer zu beklagen.
Aus der Pressekonferenz von Gesundheitsministerin Marisol Touraine und dem Neurologen Gilles Edan, Rennes, 15. Januar 2016:
Mehr / Quellen:
Zu den Mitteilungen von Bial Pharma.«Ce que l’on sait de l’accident survenu lors d’un essai clinique à Rennes», in: «Le Monde».«Patient dies in phase I trial of Bial pain drug», in: «BioWorld»«Essai thérapeutique à Rennes : chronologie d'un drame», in: «Pourquoi Docteur»«Accident thérapeutique à Rennes : 'On a pensé qu'il s'agissait d'un AVC', déclare le professeur Pierre-Gilles Edan», in: «FranceTV Info»«Bial's Clinicial Trial in France Ends In Disaster. What Went Wrong?», in: «Forbes»